Bref résumé des différents chapitres bordés et des séances de laboratoire du cours de sciences naturelles
| N° | Titre | Date |
|---|---|---|
| 1 | Ordres de grandeur dans l’Univers | 04/09/2007 |
| 2 | Latitude et longitude | 11/09/2007 |
| 3 | La matière | 02/10/2007 |
| 4 | Croissance | 22/01/2008 |
| 5 | Croissance de bactéries | 04/03/2008 |
| 6 | Distillation | 11/03/2008 |
| 7 | Énergie et rendement | 08/04/2008 |
Création d’un tableau dans SPIP et ordre de grandeur dans l’Univers
Nous avons appris à utiliser SPIP et à confectionner des tableaux.
Voici le premier tableau réalisé dans SPIP concernant différents astres, on y découvre le nom de l’astre, le rayon, le rayon en mètre puis le volume en kilomètre cube.
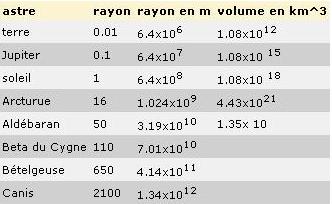
Échelles et distances dans l’Univers
Les réponses aux questions ont été trouvées sur le site de l’Observatoire de Paris
Quelques définitions
Galaxie
Ensemble comprenant quelques millions à quelques milliards d’étoiles, ainsi qu’une quantité plus ou moins grande de gaz et de poussières, et très probablement aussi un halo étendu de matière noire.
Etoile
Une étoile est une énorme sphère de gaz dont la température centrale peut atteindre des millions de degrés, ce qui déclenche au centre des étoiles des réactions thermonucléaires ; une étoile est donc une source de lumière.
Notre étoile s’appelle : Soleil.
Il se trouve dans la Galaxie du nom de : Voie Lactée.
Les galaxies les plus proches de nous sont le Grand Nuage et le Petit Nuage de Magellan, deux galaxies irrégulières visibles seulement de l’hémisphère terrestre sud et situées à une distance de 162 000 et 195 000 années lumière respectivement. Elles sont facilement visibles à l’oeil nu. La galaxie la plus proche visible de l’hémisphère nord est Andromède, qui est à 2 millions et demi d’années lumière de la Voie Lactée. On peut la voir facilement avec une paire de jumelles.
Latitude et longitude
La position d’un point sur une sphère peut être donnée par deux nombres : sa latitude et sa longitude.
Ces deux nombres représentent des angles exprimés en degré et fraction de degré.
La latitude mesure l’angle entre le plan de l’équateur et le lieu. Le pôle Nord est donc à une latitude de 90°.
Latitude et longitude : laboratoire
Théorie : La position d’un point sur une sphère peut être donnée par deux nombres : sa latitude et sa longitude.
Ces deux nombres représentent des angles exprimés en degré et fraction de degré. La latitude mesure l’angle entre le plan de l’équateur et le lieu. Le pôle Nord est donc à une latitude de 90°. Genève est à une longitude de 46°. Le pôle Sud est à une latitude de -90°. La longitude mesure l’angle entre un méridien de référence et le lieu.
Ce méridien de référence est le méridien de Greewich. A l’est de ce méridien, les longitudes sont positives, et à l’ouest elles sont négatives. Elles s’étendent de 0 à 180° à l’est et de 0 à -180° à l’ouest.
Consignes pour le laboratoire :
1. Vous devrez placer un fil sur votre sphère qui passe par les deux pôles.
2. Vous allez ensuite mesurer la longueur de ce fil
3. Sachant qu’un tour complet correspond à 360°. vous pourrez placer n’importe quel point de latitude et longitude connues.
Voici un petit exemple :
On donne les deux villes suivantes :
Genève latitude 46° 10’ longitude 6° 9’
Los Angeles latitude 34.1° longitude -118.4°
Genève=
46+ 10/60= 46.166/360
Nous cherchons le nombre de cm qui correspondent à une longitude de 6° 9’
6+9/90= 6.15
6.15/360*157= 2.68208
Voici la note obtenue :

Conclusion et apréciation générale des 2 premiers cours :
J’ai trouvé le laboratoire très intéressant. Ceci dit, le temps étant pas assez suffisant, la note n’a pas été super. Concernant le cours, les premiers cours ont étés très passionants, et on a tout de suite commencé à travailler et à étudier les différentes unités de mesure, planètes etc... ce qui a eu pour but de nous faire apprendre tout de suite ce que sont les sciences naturelles.
La matière
3ème cours
Voici le fichier PDF qui explique en détail ce que signifie la matière :
Cet article a été rédigé à partir des cours de Messieurs Caillet, Dieci, Farinelli, Quintaje en juin 2004.
Les origines et la découverte de la matière par nos ancêtre sont au début de l’article. Il explique comment notre ancêtre a pu trouvé quelques réponses à ses questions et comment les premiers hommes ont pu trouvé des réponses à des questions existentielles.
La matière se divise en 3 catégories (états) bien distinctes :
L’état gazeux : Molécules très éloignées les unes des autres. Les gaz sont compressibles car ils n’ont pas de volume propre. Ils s’agitent continuellement en un mouvement désordonné et aléatoire appelé mouvement Brownien.
L’état liquide : Molécules plus proches que les molécules gazeuses. Les liquides sont incompressibles : leur volume reste constant quelle que soit la pression exercée. Ils n’ont pas de forme propre et occupent la forme que leur donne le récipient. Les molécules de liquide sont libres de leur mouvement (mouvement Brownien).
L’état solide : Molécules très proches les unes des autres. Forces intermoléculaires fortes. Les molécules n’ont pas de mouvement Brownien, elles vibrent sur place. Les solides sont par conséquent incompressibles et ont une forme et un volume bien définis.
Définition du mot : changement d’état
On appelle changement d’état la transformation au cours de laquelle la matière passe intégralement de l’un des trois états à un autre sous l’influence de la température ou/et de la pression.
Pour exemple, voici un tableau représentatif des différentes transformations avec les différents noms des changements d’état :
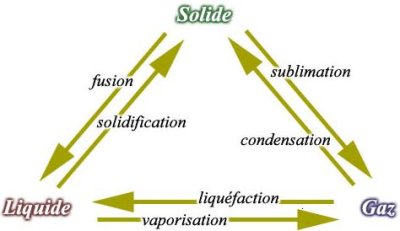
Phénomène physique
Les différences entre phénomène physique et chimique :
a) les phénomènes qui n’altèrent pas la nature intime de la matière constituent les phénomènes physiques. Exemple : les changements d’état de la matière.
b) un phénomène qui modifie profondément la nature intime des corps en les transformant en d’autres corps est appelé : phénomène chimique. Exemple : combustion d’un ruban de magnésium.
Les techniques de séparation physiques
1. La filtration (mélange liquide - solide)
– >Lorsque le solide se dépose difficilement on fait passer le mélange au travers d’un papier filtre ou d’un verre fritté. Cette opération peut se faire à pression atmosphérique ou encore sous vide. Cette technique est basée sur la grosseur des particules. Exemple : papier filtre pour le café
2. La décantation (mélange liquide - liquide ou liquide - solide)
– >Si le mélange se présente sous la forme d’un solide mélangé à un liquide, ou de deux liquides non miscibles, la décantation est l’opération la plus simple pour séparer les constituants du mélange. Cette technique n’est possible que si le solide se dépose facilement au fond du récipient. Elle est basée sur la force de gravité qui agit sur la masse volumique des substances mélangées. Exemples : sédiments en suspension, séparation de l’eau et de l’huile.
3. La centrifugation (mélange liquide - solide)
– >Lorsque la décantation ou la filtration sont difficiles à réaliser, la technique la plus simple pour séparer un mélange solide - liquide est la centrifugation, sorte de décantation accélérée. Cette opération met à profit la force centrifuge (100 à 1000 fois la force de graviter). On provoque ainsi la sédimentation du solide au fond de l’éprouvette.
4. L’évaporation (mélange liquide - solide)
– >Technique basée sur l’évaporation du solvant. Exemples : marais salant, dessalement de l’eau de mer.
5. La distillation (mélange liquide - liquide)
– >Sous l’action de la chaleur, les constituants d’un mélange de liquides vont se vaporiser au fur et à mesure que leur température d’ébullition est atteinte. On récupère alors les produits purs en condensant les fractions par refroidissement. Cette technique est basée sur la différence de point d’ébullition. Exemple : la distillation du vin pour en extraire uniquement l’alcool
6. L’aimantation (mélange solide - solide ou liquide - solide)
– >Cette technique est basée sur les propriétés magnétiques des substances à séparer. Exemple : tri du fer et de l’aluminium.
7. La sublimation (mélange solide - solide)
– >Elle permet la séparation d’un mélange de solide selon leur point de sublimation.
Les corps purs
On peut les classer en deux catégories :
– >les corps purs simples ->les corps purs composés
Corps purs simples : ils sont constitués d’atomes ou de molécules d’un seul type d’élément.
Corps purs composés : ils sont constitués de molécules formées d’atomes de plusieurs éléments.
Les éléments
Toutes les substances de l’Univers peuvent être décomposées en une centaine de produits : les ELEMENTS. Il existe 118 éléments (92 naturels).
Conclusion et appréciation générale :
La matière à été un des sujets les plus difficiles, mais pourtant si simple à comprendre quant on a de la logique ! Un sujet passionant, et sûrement le sujet que j’ai le plus apprécié de toute l’année !
Note à l’épreuve->

Croissance
Définition
Les phénomènes de croissance concernent surtout la matière vivante (on peut toutefois en observer quelques-uns dans le monde de la matière inanimée : croissance des glaciers, des stalagmites, des stalactites, des cristaux, etc.)
Cours en classe entière sur les phénomènes de croissance
Phénomènes de croissance
Première observation :
On observe très fréquement des croissances très rapides qu’on appelle exponentielles. Dans le mot exponentielle il y a le mot exposant. Voici un exemple de relation exponentielle
![]()
Pour la croissance d’une population de N individus, cette relation s’écrirait
![]()
Dans cette expression, N représente le nombre d’individus, ![]() le nombre initial (lorsqu’on commence l’observation, au temps t=0) et t le temps qui s’écoule. Pour avoir l’image, vous écrivez :
le nombre initial (lorsqu’on commence l’observation, au temps t=0) et t le temps qui s’écoule. Pour avoir l’image, vous écrivez :

Croissance des bactéries (boîte de Pétri)
Ayant fait le rapport sur papier et non sur SPIP, je résume ce que nous devions faire :
1- Faire une croix sur la boîte de Pétri, et mettre A B C D sur chaque compartiment.
2- Faire une empreinte avec l’objet qu’on désirait. (par exemple, moi j’ai mis mon doigt, de la salive imbibée sur un côton tige, mon doigt de pied ainsi qu’une bague)
3- Emmener la boîte de Pétri chez soi, puis noter les observations toutes les 24 h.
4- Faire un rapport détaillé et rendre la semaine suivante.
Finalement, nous avons dû construire un tableau. Les données du tableau ont étés obtenues grâce aux observations faîtes.
Ce qui m’a donné ceci :
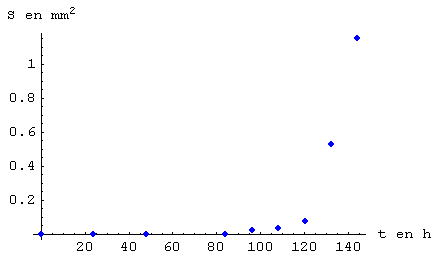
Conclusion et apréciation générale :
C’était un rapport que j’avais déjà fait l’année passé. Mais cette année, je l’ai fait avec encore plus de détails. Ma note à été de 5, mais elle n’est pas définitive, car il y a eu des mal-entendus.
Le meilleur rapport qu’on a pu faire durant l’année.
Distillation
Nous avons observé la distillation du vin.
Le but était de séparer un mélange (l’acool du vin) en utilisant le procédé de la distillation.
Le matériel était :
– >Un dispositif permettant de chauffer
– >Un ballon pour introduire le vin
– >Des fioles pour récupérer la substance isolée
voici le dispositif qui nous a permis de voir la séparation :

L’adresse de la photo est
<img4638|center>
Les étapes :
– 1ere étape : la vaporisation
LIQUIDE -> GAZ
– 2eme étape : la liquéfaction
GAZ -> LIQUIDE
Résultats :
- 1ere fiole : Le liquide est uniquement de l’alcool, nous pouvons nous en rendre compte grâce à l’odeur très forte qu’il dégage.
- 2eme fiole : L’odeur est un peu moins forte, l’alcool est toujours en grande quantité dans le récipient mais l’eau qui commence à s’évaporer vient s’ajouter au mélange.
- 3eme fiole : Il y a de plus en plus d’eau qui s’ajoute à l’alcool, l’odeur s’atténue.
- 4eme fiole : Il n’y a presque plus d’alcool, l’alcool lui a fini son évaporation et l’eau pas encore. On ne sent presque plus l’odeur de l’alcool.
Conclusion et apréciation générale :
C’était très intéressant de voir comment on pouvait retirer l’alcool pur du vin. Mais, l’alcool avait encore un arrière goût de vin, cela est dû sûrement aux arômes. Dommage qu’on n’ait pas pu faire cette expérience avec un autre alcool que du vin.
Énergie et rendement
Qu’est ce que l’énergie ?
Nous pouvons donner une définition simple : l’énergie c’est ce qui permet de faire quelque chose. L’énergie peut se présenter sous différentes formes : énergie hydraulique (barrages), énergie électrique, énergie nucléaire, énergie solaire, énergie thermique, etc. L’énergie se mesuse en joule J.
– >Pour calculer en joule la quantité d’énergie en réserve, on utilise la formule suivante :
masse*accélération terrestre*différence de hauteur
Epot=m*g*Δ H
– >transformer l’énergie cinétique en énergie éléctrique :
![]()
Énergie électrique
Lorsque qu’on utilise un appareil éléctrique, on le branche sur le secteur (tension de 220 volts V). Lorsqu’un appereil est soumis à cette tension, il est parcouru par un courant éléctrique dont l’intensité s’exprime en ampère A.
Voici toutes les différentes formules apprises :
La relation qui lie la tension et l’intensité du courant qui parcourt l’appareil à sa puissance est donnée par
Puissance= tension*intensité du courant
P=U*I
La relation entre l’énergie transformée, la puissance et le temps est la suivante :
Puissance= Energie/ temps
![]()
Energie= Puissance*temps
Si on exprime la puissance en kilowatt (kW) et le temps en heure (h), on obtient l’énergie en kilowattheure.
Lorsqu’on chauffe de l’eau on transforme de l’énergie électrique en chaleur. Cette énergie transformée en chaleur peut s’exprimer par
![]()
Le rendement est défini de la manière suivante :
![]()
Conclusion et apréciation générale :
Ce dernier chapitre des sciences naturelles était particulièrement difficile à apprendre. Malgré de gros efforts, peu d’élèves ont obtenu la moyenne. Ayant obtenu un 4.5, j’estime que j’ai pas encore assez compris ce chapitre. Malgré cela, ce fût un des chapitres les plus intéressants de l’année !
Remarques : J’espère que vous ferez preuve de compréhension. Malgré le fait que ce résumé ne soit pas parfait, j’ai dû lutter pour réussir à écrire cet article, car internet n’arrêtait de « boguer ».
Remarques personnelles :
J’ai passé une très bonne année de sciences naturelles, d’une part, parce que ça nous a permis d’apprendre beaucoup de choses nouvelles, et d’autre part, parce que ça nous a permis de travailler en harmonie, en groupe (pendant les leçons de laboratoire).
Merci beaucoup pour cette année de sciences naturelles. Ce fût un plaisir d’être votre élève durant cette année 2007-2008.
Filipe Carreira, D2m1 Mercredi 21 mai 2008
