Bref résumé des différents chapitres abordés et des séances de laboratoire du cours de sciences naturelles
| Table des matières |
|---|
1. Introduction
Objectifs
– apporter l’information minimum permettant de développer la curiosité et l’intérêt scientifique, la compréhension de phénomènes courants, qu’ils soient naturels ou techniques
– expliquer l’univers du niveau microscopique au niveau macroscopique, le monde vivant et non-vivant
– familiariser avec les méthodes scientifiques en développant les capacités suivantes :
– observation
– formulation de questions
– analyse d’un texte scientifique simple
– utilisation d’un mode opératoire
– utilisation d’appareils pour l’expérimentation
– présentation et interprétation des résultats
– initier aux sciences de la nature et à leur utilisation dans la vie quotidienne en relation avec l’actualité scientifique ou médicale
– permettre de maîtriser certains concepts essentiels relatifs à l’étude des interactions de l’homme avec son environnement
– développer la conduite d’un raisonnement rigoureux et logique
Thèmes
– sources d’énergie et de matières premières
– transformations d’énergie
– principaux cycles de la matière (eau, azote, carbone)
– étude d’un écosystème, équilibre et déséquilibre
– notion de chaîne alimentaire
– formation de l’univers et apparition de la vie
– évolution des êtres vivants
– génétique, diversité des populations humaines et histoire de l’homme
– influence de l’homme sur l’environnement
– environnement et santé.
2. Premiers pas sur SPIP
Nous avons tout d’abord commencé à apprendre à rédiger des articles sur SPIP. Ce sera important par la suite car c’est grâce à cet outil que l’on pourra prendre des notes des cours pour ensuite pouvoir les consulter sur le site lors des épreuves.
Nous avons appris toutes les choses qui nous permettent d’écrire des articles, comme des tableaux, insérer des images, des liens et aussi la mise en forme du texte.
Appréciations
C’est quand même assez important d’apprendre toutes ces notions car nous utilisons pratiquement toujours SPIP. Je trouve que c’est très pratique car c’est aussi grâce à SPIP que j’ai pu faire ce résumé.
3. Ordres de grandeur dans l’Univers
Nous avons étudié la notation scientifique à cause des grandes distances dans l’Univers. Nous avons appris ce que valait un trillionième, le volume du Soleil en m^3, ce qu’était une galaxie, des étoiles et combien on peut en trouver dans l’Univers (énormément !).
Nous avons même réalisé une séance de laboratoire qui consiste à piquer des points grâce à des épingles sur une sphère en sagex pour pouvoir mesurer la distance entre deux villes en ne connaissant que la latitude et la longitude. Nous avons d’abord fixé le pôle Nord et le pôle Sud, nous avons tiré un fil qui passe par les pôles décrivant ainsi un grand cercle (360°) et ensuite nous avons mesuré la distance entre deux épingles, en estimant les incertitudes.
Plus d’informations ici.
Appréciations
Un chapitre très intéressant car je pense que c’est bien d’avoir en tête une image précise de l’Univers et tout ce qui le compose. En même temps, les cours d’astronomie m’ont bien aidé dans ce chapitre.
La séance de laboratoire m’a permis d’apprendre à placer une ville en ne connaissant que la latitude et la longitude sur une sphère en sagex. J’ai trouvé que c’était une très bonne première séance de laboratoire.
4. La matière
Nous avons ensuite commencé un chapitre sur la matière. Nous avons appris qu’elle peut être en trois états (solide, liquide et gaz). Nous allons examiner chaque état plus précisément.
L’état solide
Les molécules sont très proches les unes des autres et leurs forces sont très fortes. Les molécules n’ont pas de mouvement Brownien, elles vibrent sur place. Les solides sont par conséquent incompressibles et ont une forme et un volume bien définis.
Exemple : un glacier
L’état liquide
Les molécules sont plus proches que les molécules gazeuses. Les liquides sont incompressibles : leur volume reste constant quelle que soit la pression exercée. Ils n’ont pas de forme propre et occupent la forme que leur donne le récipient. Les molécules de liquide sont libres de leur mouvement (mouvement Brownien).
Exemple : l’eau
L’état gazeux
Les molécules sont très éloignées les unes des autres. Les gaz sont compressibles car ils n’ont pas de volume propre. Ils s’agitent continuellement en un mouvement désordonné et aléatoire appelé mouvement Brownien.
Exemple : la vapeur qui sort d’un récipient lorsque l’eau atteint 100°
Changements d’état
On appelle changement d’état la transformation au cours de laquelle la matière passe intégralement de l’un des trois états à un autre sous l’influence de la température ou/et de la pression.
| Changement d’état | Nom | Exemple | |
|---|---|---|---|
| 1 | Solide -> Liquide | Fusion | La fonte des glaciers |
| 2 | Liquide -> Solide | Solidification | L’eau qui gèle |
| 3 | Liquide -> Gaz | Vaporisation | L’eau qui bout |
| 4 | Gaz -> Liquide | Liquéfaction | Formation de gouttelettes sur un miroir |
| 5 | Solide -> Gaz | Sublimation | un tas de neige qui diminue |
| 6 | Gaz -> Solide | Condensation | le gaz carbonique se transforme en neige carbonique |
Nous avons fait un rapport sur les mélanges et les corps purs qui consistait à séparer des mélanges de solides (chlorure de sodium, sable, diiode et limaille de fer). Nous avons fait 4 mélanges.Voici en résumé ce qui a été fait :
– 1. quatre solides (chlorure de sodium, sable, diiode et limaille de fer) => mélange hétérogène => iode (état gazeux)
– 2. quatre solides (...) => mélange hétérogène => limaille de fer
– 3. trois solides (chlorure de sodium, sable, diiode) => mélange hétérogène => eau salée
– 4. eau salée => mélange homogène => sel (solide)
Nous avons également réalisé une expérience sur la distillation. Cette expérience nous a servi à distiller le vin, c’est-à-dire séparer l’alcool et l’eau du vin. Nous avons effectué cette distillation grâce à ce matériel :

L’adresse de la photo est
<img4638|center>
La démarche consiste à faire chauffer le vin dans un ballon. Comme nous savons que l’alcool s’évapore à environ 70° tandis que l’eau s’évapore à 100°, l’alcool devrait être la première substance qui devrait être séparée.
Nous avions 4 fioles à disposition, et au fur à mesure que le temps passait, l’alcool se sentait de moins en moins.
Cela confirme l’hypothèse de départ, qui est que l’alcool s’évapore avant l’eau, même si dans les deux dernières fioles, nous pouvons sentir encore un peu d’alcool, bien que l’eau est plus présente (il n’y a pas de gros écart entre les températures d’évaporation de l’alcool et l’eau).
Appréciations
Je connaissais déjà quelques termes comme les états de la matière, grâce aux anciens cours de physique. Le rapport que nous avons fait était intéressant, surtout lorsque nous devions séparer des mélanges de solide. Celui de la distillation était un peu court.
5. Les cycles de la matière
Récupération
– Cycle du verre
– Cycle PET (bouteilles de plastique)
– Cycle du papier
– Cycle de l’aluminium
Cycles naturels
– Cycle de l’eau
– Cycle du carbone
– Cycle de l’azote
– Cycle des roches
Nous avons vu plus précisément le cycle de l’eau, par exemple, nous avons appris que ce que nous voyons au-dessus d’une casserole, lorsque l’eau bout, ce n’est pas du gaz d’eau mais des gouttelettes. Cette eau est pure lorsqu’elle se liquéfie.
Nous avons également appris de nouveaux termes, comme la bruine qui est en fait une pluie de très fines gouttes. Un chêne peut perdre environ 500 litres en un jour et que l’évaporation apporte de l’eau à l’atmosphère pour fabriquer les nuages.
Plus d’exemples par ici.
Un quizz très sympa à faire ici.
Appréciations
Ce chapitre était un peu court mais il y a des informations utiles à retenir. De plus, le quizz que nous avons fait m’a permis de bien comprendre quelques notions que je connaissais très vaguement.
6. Phénomènes de croissance
Dans ce nouveau chapitre, nous avons vu que les phénomènes de croissance concernent surtout les matières vivantes (même si on peut en observer sur les matières inanimées comme les glaciers ou des cristaux).
Nous avons donc appris à utiliser un logiciel qui se nomme Stella qui nous permettra de construire des modèles de ce genre :
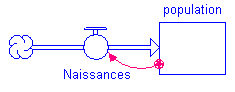
En fait, un modèle nous permet de représenter un phénomène de croissance. Nous pouvons donc représenter une population à l’aide d’un réservoir. Pour la faire évoluer, nous avons besoin d’un flux (tuyau avec valve) qui modifie le contenu du réservoir. Nous devons maintenant entrer des données pour que notre modèle "prenne vie".
Pour ce faire, nous ouvrons Stella, nous cliquons ensuite sur le bouton en haut à gauche qui représente un globe. Il y aura alors des points d’interrogations qui apparaîtront dans le réservoir et dans la vanne du flux. Nous devons donc insérer un nombre initial dans le réservoir qui représente une population. Admettons que nous mettons 10 . Tandis que dans la vanne du flux, nous ne devons pas insérer une valeur, mais une relation car cette vanne est en effet liée à la population, ce qui signifie que les naissances dépendent de la population. Nous supposons une relation de proportionnalité entre le nombre de naissances par unité de temps et la population, ce qui peut s’écrire :
| naissances par unité de temps = constante * Population |
|---|
Ce qui signifie que les naissances par unité de temps sont proportionnelles à la population.
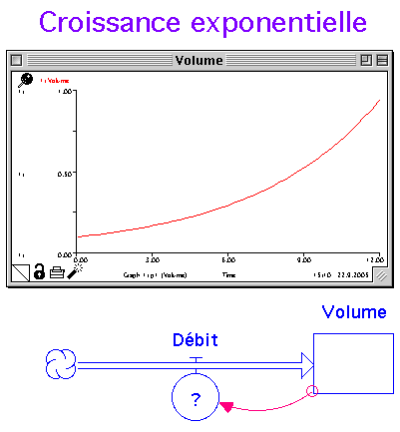
On observe très fréquemment des croissances très rapides qu’on appelle exponentielle. Dans le mot exponentielle, il y a le mot exposant. Voici un exemple de relation exponentielle.
| y= 10^x |
|---|
Pour la croissance d’une population de N individus, cette relation s’écrirait
| N= N0 * 10^t |
|---|
Dans cette expression, N représente le nombre d’individus, N0 le nombre initial (lorsqu’on commence l’observation, au temps t=0) et t le temps qui s’écoule.
Nous allons maintenant faire un modèle sous Stella, où la population est représentée par un réservoir, les naissances par unité de temps par un flux et la constante par un petit cercle. Ensuite nous tirons une flèche qui part de la population ( le N ) vers le flux naissances, ainsi qu’une autre flèche qui relie la constante aux naissances. A l’intérieur de ce flux, nous mettons la relation naissances par unité de temps = constante * Population.
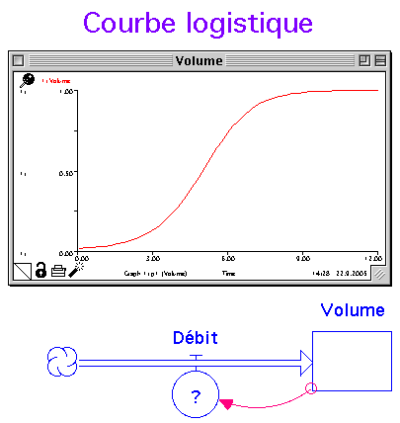
La croissance limitée
On observe presque toujours dans les phénomènes de croissance, un début de croissance exponentielle qui conduit à un effectif stable au cours du temps. Il faut trouver un moyen de limiter la croissance. Lorsque la population est faible, on veut quelque chose qui soit de type exponentiel. Lorsqu’elle est importante, on veut que les naissances s’annulent. Voici quelques formules :
| naissances par unité de temps = constante * population * (population maximum-population) |
|---|
Si on travaille en %, la population max vaut 1 = 100%
| naissances par unité de temps = constante * population * (1-Population) |
|---|
Pour comprendre plus précisément cette croissance, nous avons fait une observation sur une durée de 7 jours qui portait sur les croissances de bactéries.
Nous avons donc reçu chacun une boîte de Petri ensemencée en forme de cercle que nous avons limité en 4 zones. Dans chacune de ces zones, nous avons légèrement touché la surface avec tout types d’objets ou avec nos doigts. Selon le type d’objet ou de doigt en contact avec une de ces zones, la croissance de colonies de bactéries était différente. Dans certains endroits, il y avait plus de colonies que dans d’autres.
Un tableau d’observations d’événements est disponible à cette adresse.
Appréciations
J’ai trouvé ce chapitre très long, sûrement le plus long de tous les autres. Même s’il y avait quelques notions importantes à connaître, j’ai trouvé cette partie du cours très répétitive.
Par contre, l’observation de croissance des colonies de bactéries était assez originale car je n’avais jamais fait quelque chose de ce genre là.
7. Energie, puissance et rendement
Nous voici arrivés au dernier chapitre qui va traiter de l’énergie. Qu’est-ce que l’énergie ? L’énergie c’est ce qui permet de faire quelque chose. Il existe différentes formes d’énergie :
– l’énergie solaire, l’énergie éolienne, l’énergie géothermique (énergies renouvelables)
– l’énergie nucléaire, l’énergie thermique (combustion du charbon, du mazout, du bois, etc), l’énergie potentielle (retenues d’eau des barrages)
Energie potentielle
L’énergie potentielle d’une masse d’eau m retenue par un barrage situé à une altitude h est donnée par
| Epot = m*g*h |
|---|
– où m est la masse en kilogramme
– g est l’accélération terrestre 9.81 m/s^2
– h est l’altitude en mètre
L’unité de l’énergie est le joule .
Energie cinétique
L’énergie cinétique est associée au mouvement. Elle fait intervenir la masse et la vitesse.
![]()
– où m est la masse en mouvement en kg
– et v la vitesse du mouvement en m/s.
Exemple : une voiture de 1200 kg roule à 54 km/h. Que vaut son énergie cinétique ?
![]() = 135 000 J
= 135 000 J
Bien évidemment, il ne faut pas oublier de convertir les km/h en m/s et nous allons le faire de cette manière :
– 1 km/1 h = 1000 m/3600 s
– Il faut donc diviser par 3.6
| 54/3.6 = 15 |
|---|
Energie électrique
Lorsqu’un appareil électrique est branché sur un secteur (en Suisse, les prises ont une tension U de 220 V ), il est parcouru par un courant électrique d’intensité I . Ces grandeurs sont reliées entre elles par la relation suivante :
| P = U * I |
|---|
Cette puissance se mesure en watt ( W ). Une puissance de 1 W correspond à une dépense d’énergie de 1 joule (J) en 1 seconde (s).
Voyons maintenant un exemple : Un athlète a fait 15 pompes en 10 secondes. On admet qu’il soulève une masse de 40 kg sur distance de 60 cm. Calculer l’énergie dépensée par l’athlète ainsi que sa puissance.
Nous allons donc utiliser la formule de l’énergie potentielle pour calculer l’énergie dépensée pour 15 pompes :
| 40 * 9.81 * 0.6 * 15 = 3531.6 J |
|---|
Maintenant, nous devons calculer la puissance. Voici la formule qui nous permet de faire ce calcul :
| Puissance = Energie / Temps |
|---|
Nous connaissons déjà l’énergie (3531.6 J), il nous reste plus qu’à diviser cette valeur par le temps en secondes (10 s), ce qui nous donne :
| Puissance = 3531.6 J / 10 s = 353.16 W |
|---|
Pour essayer de comprendre un peu mieux ce chapitre, nous avons fait un dernier rapport qui consistait à déterminer le meilleur moyen pour chauffer 3 dl d’eau à 100°. Nous avions donc besoin de connaître le rendement de chaque appareil pour découvrir le meilleur moyen. Nous avions 4 appareils à disposition :
– Four à micro-ondes
– Plaque électrique chauffante.
– Bonbonne de gaz (propane/butane)
– Bouilloire électrique
Nous avons d’abord essayé la bonbonne de gaz. Nous avons laissé chauffer l’eau jusqu’à un certain temps (qui était un peu trop long à nos goûts). Pour calculer le rendement, nous avons besoin de connaître l’énergie fournie et l’énergie reçue . Voici les différentes formules :
| E reçue = c*m*Delta T |
– où c = chaleur massique de l’eau (4180 J * kg^-1 * °C^-1)
– m est la masse de l’eau (ici elle est de 0,55045 Kg)
– Delta T est la différence entre la température que nous avons à la fin et au début (dans ce cas, elle est de 60° - 19°)
| E reçue = 0,55045 Kg*4180*41°(60 -19) = 94’336,12 J |
Une fois que nous avons l’énergie reçue, nous avons besoin de l’énergie fournie qui se calcule de cette manière :
| E fournie = P * t |
Ce cas-là est spécial parce que nous avons eu besoin de calculer la masse de la bonbonne de gaz avant de commencer l’expérience, et également après. Ce résultat nous donne la quantité de gaz brûlé. Cela nous donne 4,95 g (les détails se trouvent sur le rapport que nous avons rédigé). Il faut donc faire une règle de trois :
| 1 g -> 46’000 J
4,95 g -> x |
|---|
| E fournie = 4,95*46’000 = 227’000 J |
Nous pouvons maintenant calculer le rendement :
| Rendement = E reçue / E fournie * 100 |
| Rendement = 94’336,12 J / 227’000 J * 100 = 41,43 % |
|---|
Nous avons fait le même raisonnement pour les 3 autres appareils restants. Nous avons trouvé que le moyen le plus rapide pour faire bouillir l’eau est la bouilloire, et c’est aussi le moyen qui gaspille le moins d’énergie vu qu’il a le meilleur rendement !
Voici le lien du rapport qui a été publié sur le site
Appréciations
J’ai trouvé ce dernier chapitre très intéressant. Le rapport que j’ai fait avec George était bien recherché car je pense que c’est une bonne chose de connaître le rendement d’un appareil. D’ailleurs, je pensais que le micro-onde avait le meilleur rendement mais il arrive parfois de se tromper. Je suis aussi très content que le rapport ait été publié sur le site, ce qui signifie que nous avons fait du très bon travail.
Conclusion
En général, j’aimerais remercier monsieur Vuilleumier qui a bien donné ses cours, avec une très bonne ambiance qui régnait en classe. C’était une année positive, les cours étaient dans l’ensemble assez intéressants ainsi que les séances de laboratoires qui nous ont permis de voir les choses différemment par rapport à ce qu’on voyait aux cours.
